IV. Dernière couche
Tout d'abord, il faut savoir que les deux poudres présentées au début du tour ne sont pas les mêmes ! L'une d'entre elles est du sel fin, l'autre une poudre récupérée dans les couches jetables pour enfant : le polyacrylate de sodium, un polymère super absorbant. A l'aide d'un forçage classique en prestidigitation, nous avons utilisé le polymère en premier. Nous allons voir comment le polymère a pu rendre l'eau "solide", et comment le sel a pu la rendre liquide à nouveau.
A. Présentation général du polymère, le polyacrylate de sodium
Un polymère est "un système formé par un ensemble de macromolécules de même nature chimique, issu de l'enchaînement covalent de motifs
( ou unités ) monomères". En clair, un polymère est un enchainement d'éléments chimiques ( souvent des molécules ) identiques,
comme on le voit sur ce schéma :
 Un monomère est donc bien un "motif" qui se répète. Le polymère que nous utilisons, le polyacrylate de sodium, a pour formule
[-CH2-CH(COONa)-]n, c'est-à-dire que le motif de base et qui se répète est
Un monomère est donc bien un "motif" qui se répète. Le polymère que nous utilisons, le polyacrylate de sodium, a pour formule
[-CH2-CH(COONa)-]n, c'est-à-dire que le motif de base et qui se répète est
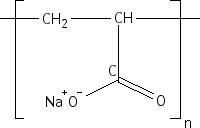 qui se répète donc n fois. Nous avons schématiser le polymère pour que l'explication soit plus visuelle :
qui se répète donc n fois. Nous avons schématiser le polymère pour que l'explication soit plus visuelle :
 Voici donc comment se présente le polymère en absence d'eau : une alternance de CH2 et de CH(COONa), liés entre eux.
Ceci correspond à la poudre qui se trouve dans le pot présenté.
Voici donc comment se présente le polymère en absence d'eau : une alternance de CH2 et de CH(COONa), liés entre eux.
Ceci correspond à la poudre qui se trouve dans le pot présenté.
B. Premier phénomène en milieu aqueux : le déploiement
Cependant, lorsque nous versons de l'eau, la situation change radicalement. Nous allons dans cette partie décrire le premier phénomène
qui se déroule lorsque le polymère est en milieu aqueux.
Dans un premier temps, le Na du polymère va partir dans l'eau pour donné les ions Na+. Par conséquent, le
polymère va devenir une alternance de CH2 et de CH(COO-). Chaque motif est donc globalement négatif : ils vont
se repousser mutuellement ( deux éléments de charges négatives -ou de charges positives- se repoussent ), le polymère va alors se
déployer.
Les Na qui se "détachent" vont avoir une deuxième conséquence. En effet, l'eau à l'intérieur du polymère va être chargée en
Na+, l'eau va être plus concentrée. Pour rétablir une concentration homogène dans le bécher, l'eau va pénétrer dans
le polymère ( pour répartir les Na+ ). Le schéma suivant récapitule la première étape :

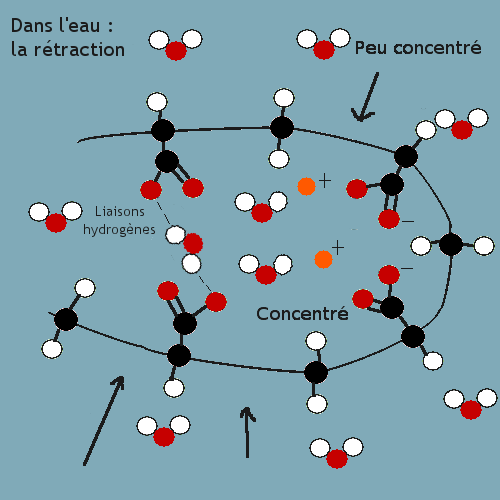
C. Deuxième phénomène en milieu aqueux : la rétraction qui assure la cohésion
Dans un deuxième temps, des liaisons hydrogènes vont se former entre les éléments chargés négativement du polymère, bien qu'il ne
possèdent qu'un électron ( réaction spécifique de la formation de "liaisons hydrogènes" ).
Cette réaction va avoir de multiples conséquences. Tout d'abord, le polymère va se rétracter à cause des liaisons ( un peu à la manière
de l'ovalbumine ). De plus, les H qui vont "s'accrocher" au polymère vont donc former des "liaisons hydrogènes", limitant les
mouvements d'eau en formant des "barrages". Ainsi, l'eau ne va presque plus rentrer dans le polymère, mais n'en sortira pas non plus.
Enfin, le milieu restera
plus concentré à l'intérieur qu'à l'extérieur, et l'eau qui restera "libre", pas emprisonnée par le polymère, va vouloir entrer et va
donc exercée une pression sur les parois, assurant une fois de plus la cohésion du polymère; c'est la pression osmotique.
Le schéma suivant récapitule cette deuxième étape :
 Enfin, au vue de la masse moléculaire très élevée du polymère, celui-ci ne va pas se dissoudre pour former des ions, mais il va bien se
gélifier. Enfin, le réseau des polymères est un réseau en trois dimensions, et on va bien avoir des "poches" d'eau. Ce phénomène pourrait
être assimilé à la coagulation de l'œuf vue au I..
Enfin, au vue de la masse moléculaire très élevée du polymère, celui-ci ne va pas se dissoudre pour former des ions, mais il va bien se
gélifier. Enfin, le réseau des polymères est un réseau en trois dimensions, et on va bien avoir des "poches" d'eau. Ce phénomène pourrait
être assimilé à la coagulation de l'œuf vue au I..
D. Le retour à l'état liquide
En rajoutant du sel fin, l'ensemble redevient liquide. La réaction n'est pas connue en détail, mais on peut affirmer qu'il y a une compétition entre les interactions eau/polymère et eau/sel. En effet, le sel ( de formule NaCl ) va se dissoudre dans l'eau pour donner les ions Na+ et Cl-. L'eau va préférer réagir avec le sel, et plus on ajoute de sel, moins il y aura de liaisons eau/polymère, et plus le milieu sera liquide.
Conclusion
Encore une fois, la science a permis d'expliquer le tour. Elle a encore un rôle révélateur. Cependant, la démarche suivie ici est complètement inversée : nous avons d'abord trouvé le phénomène, puis nous l'avons adapté dans un tour. La science a donc permis de créer ce tour : un rôle créatif.
