I. Assaisonner le tour
Avant d'expliquer comment l'œuf peut passer à travers la bouteille, nous allons faire une première révélation. En effet, à l'aide d'une manipulation fréquente en prestidigitation, nous avons échangé l'œuf "normal", avec un œuf qui a subi des modifications, et qui est donc mou. Cependant, nous avons fait le choix de garder la coquille pour rendre le tour plus impressionnant; la triche n'est donc pas complète, et l'utilisation de la science non niable. Avant même de se demander comment l'œuf peut passer dans le goulot, nous allons tout d'abord montrer comment l'œuf a pu ramollir ainsi.
A. Durcir l'intérieur
L'opération principale consiste à ramollir la coquille. Cependant, comme nous l'avons observé lors de nombreux tests, l'œuf éclate car il
est encore trop liquide à l'intérieur, et en se rétrécissant pour passer dans le goulot, l'œuf explose. Il faut donc dans un premier temps
faire durcir l'intérieur de l'œuf.
Pour cela, le moyen le plus simple et le plus utilisé est de faire cuire un œuf. Ainsi, tout le monde sait que l'intérieur de l'œuf durcit
en cuisant. Nous allons ici chercher à montrer pourquoi. Cependant, cette démonstration relève d'avantage de la biologie, donc nous allons
être relativement succincts.
Nous allons en particulier étudier le cas du blanc d'œuf : quelle est sa composition qui lui permet de ramollir lors de la cuisson ? Le
principal constituant du blanc d'œuf est l'ovalbumine, en solution aqueuse dans le blanc d'œuf. Les molécules d'ovalbumine ont une
structure particulière : en effet, elles sont constituées de quatre chaînes identiques qui s'assemblent, comme on le voit sur ce schéma
fait avec le logiciel RASTOP :
 En zoomant fortement sur une partie de la chaîne, on observe des liaisons dites "faibles" qui font que ces chaînes sont entortillées
ainsi :
En zoomant fortement sur une partie de la chaîne, on observe des liaisons dites "faibles" qui font que ces chaînes sont entortillées
ainsi :
 Ces liaisons faibles s'opposent aux liaisons fortes qui lient les acides aminés, les constituants de base des chaînes, comme on le voit
sur ce schéma :
Ces liaisons faibles s'opposent aux liaisons fortes qui lient les acides aminés, les constituants de base des chaînes, comme on le voit
sur ce schéma :
 En chauffant, les liaisons faibles vont être brisées, comme nous l'avons schématiser ici :
En chauffant, les liaisons faibles vont être brisées, comme nous l'avons schématiser ici :
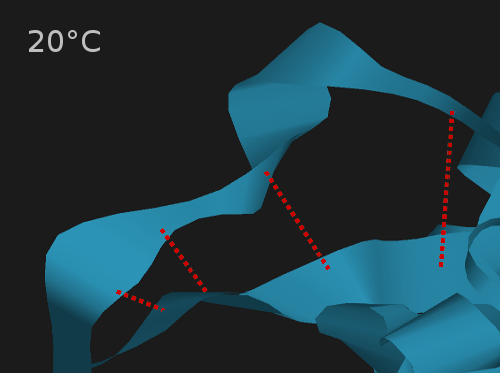
 A 57°C, les liaisons ont disparu :
A 57°C, les liaisons ont disparu :
 La molécule va donc se déplier, car les liaisons faibles qui assuraient sa structure ont disparu. Cette opération qui consiste à casser
les liaisons faibles est irréversible : quand la température redescend sous les 57°C, la molécule reste dépliée. Voici une molécule d'
ovalbumine qui a donc perdu ses liaisons : on dit qu'elle est dénaturée :
La molécule va donc se déplier, car les liaisons faibles qui assuraient sa structure ont disparu. Cette opération qui consiste à casser
les liaisons faibles est irréversible : quand la température redescend sous les 57°C, la molécule reste dépliée. Voici une molécule d'
ovalbumine qui a donc perdu ses liaisons : on dit qu'elle est dénaturée :
 Le fait que le blanc d'œuf devient dur s'explique car nous rappelons que l'ovalbumine était en solution aqueuse, c'est à dire dans l'eau. Or
l'eau est bien sous forme liquide. Cependant, en se déroulant, les chaînes vont former un réseau et emprisonner l'eau, donc l'œuf va durcir,
car l'eau serait enfermée dans des "petits" paquets, comme on le voit sur ce schéma :
Le fait que le blanc d'œuf devient dur s'explique car nous rappelons que l'ovalbumine était en solution aqueuse, c'est à dire dans l'eau. Or
l'eau est bien sous forme liquide. Cependant, en se déroulant, les chaînes vont former un réseau et emprisonner l'eau, donc l'œuf va durcir,
car l'eau serait enfermée dans des "petits" paquets, comme on le voit sur ce schéma :

Ainsi, quand on dépasse les 57°C, les liaisons se cassent, les chaînes de l'ovalbumine se déroulent, et emprisonnent l'eau dans des
réseaux : on dit qu'il y a coagulation. Un phénomène analogue se déroule pour le jaune d'œuf, à température légèrement supérieure :
65°C.
Les tests nous ont révélés que la cuisson optimale était de faire un œuf "mollet", nous faisions cuire l'œuf dans l'eau bouillante
pendant environ sept minutes.
B. Ramollir la coquille
Maintenant que nous nous sommes assurés que l'intérieur de l'œuf ne sera pas trop liquide, nous allons pouvoir ramollir la coquille de l'œuf.
Pour cela, l'opération est simple et consiste à plonger l'œuf dans du vinaigre, puis à attendre. Il se produit une réaction entre le
calcium qui assure la solidité de la coquille et l'acide acétique du vinaigre. Les réactifs de la réaction sont donc CaCO3
( le carbonate de calcium contenu dans la coquille ) et CH3COOH ( l'acide acétique du vinaigre ). De plus, CaCO3
contient la base CO32-, d'acide associé HCO3-,
lui-même ampholyte ( à la fois une base et un acide ) d'acide associé H2CO3. Le carbonate de calcium (
CaCO3 ) n'est pas soluble dans l'eau, sinon la coquille deviendrait molle dès lors qu'on plongerait un œuf dans l'eau.
Cependant, en présence d'acide acétique, seule la base CO32- va réagir. On a donc :
HCO3- = CO32- + H+
et H2CO3 = HCO3- + H+
d'où H2CO3 = CO32- + 2H+
De plus l'acide acétique CH3COOH est un acide de base associée CH3COO-, soit le couple : CH3COOH / CH3COO-
Il va donc se produire une réaction acido-basique, c'est à dire une réaction entre une base et un acide. En effet, une base
est une
entité chimique capable de capter un proton H+, et un acide, entité chimique capable de libérer un proton H+. Il va
donc y avoir un échange de protons.
Comme dit précédemment, les couples sont :
H2CO3 / CO32- et CH3COOH / CH3COO-
Les équations de demi-réaction sont donc :
CH3COOH = CH3COO- + H+
On va alors réécrire les équations dans le bon sens, les réactifs sont CH3COOH et CO32-, que nous allons donc mettre à gauche :
CH3COOH -> CH3COO- + H+
Comme il va y avoir un échange de protons, il faut le même nombre de protons libérés que de protons captés. On va donc multiplier la deuxième demi-équation par deux, de manière à avoir deux protons libérés :
2(CH3COOH) -> 2(CH3COO-) + 2H+
Nous avons donc les deux demi-réactions que nous allons réécrire ensemble pour obtenir l'équation finale.
2(CH3COOH) + CO32- -> H2CO3 + 2(CH3COO-)
Cependant, l'équation est encore injuste ! En effet, nos réactifs étaient CaCO3 et CH3COOH, pas CO32-.
En effet, seul le CO32- du CaCO3 va réagir, et qu'il nous reste donc Ca2+.
On peut donc écrire :
2(CH3COOH) + CaCO3 -> H2CO3 + 2(CH3COO-) + Ca2+
Il faut encore la modifier. En effet, pour éviter d'avoir des éléments chargés positivement et des éléments chargés négativement,
les deux CH3COO- vont s'assembler à un Ca2+ pour donner l'élément neutre Ca(CH3COO)2:
l'acétate de calcium ( utilisé comme agent conservateur en pâtisserie ).
Enfin, il faut savoir que H2CO3 "équivaut" à CO2, H2O, sinon l'équation ne serait pas entièrement
correcte. L'équation finale est donc :
Donc 2(CH3COOH) + CaCO3 -> CO2 + H2O + Ca(CH3COO)2
On remarque donc que le CaCO3 présent au départ va disparaître. Or, il assurait la solidité de la coquille, et en disparaissant, la
coquille va alors ramollir. La mousse observée à la surface du verre est due au dégagement gazeux de dioxyde de carbone ( CO2 ).
L'eau produite ne se remarque bien évidemment pas, et l'acétate de calcium est soluble dans l'eau, et ne se remarque donc pas non plus.
C. Le mettre dans l'huile
Cette dernière étape est facultative, mais elle n'est pas uniquement faite pour le jeu de mot "assaisonner"... En effet, l'œuf une fois sorti du vinaigre a tendance à être collant. A l'inverse, l'huile est bien sûr connue pour ses pouvoirs lubrificateurs. En trempant l'œuf dans l'huile, les forces de frottement subie lors du passage de l'œuf à travers le goulot seront réduites.
Conclusion
La science a bien permis ici d'expliquer pourquoi et comment l'œuf a ramolli. Elle a donc révélé une partie du tour en montrant qu'il
avait fallu ramollir l'œuf : son rôle est donc ici révélateur.
Cependant, l'œuf devait ramollir pour le "vrai" tour. La science nous a donc permis de pouvoir faire le tour à proprement parler, elle
l'a préparer, le fait de ramollir l'œuf est bien une préparation. Son rôle est donc également préparatif.
